
Aux États-Unis, la question de la vaccination des enfants revêt un aspect absolument crucial pour les fabricants car cette généralisation aux mineurs dévie automatiquement toute la gestion des effets indésirables graves vers les États, y compris pour les dégâts perpétrés chez les adultes [1]. Cette bataille homérique américano-américaine entre médecins indépendants et corrompus ne se fera pas sans retombées en Europe. La permissivité coupable de la FDA induira évidemment un suivisme catastrophique de l'Agence européenne du médicament, toute aussi gangrenée qu'elle par le cartel pharmaceutique. Tant pis pour les bébés Européens ?
Hélène Banoun vous montre ici devant quelles « bases scientifiques » incroyablement inexistantes la FDA a pourtant capitulé : si de tels chiffres ne vous indignent pas alors... Bonne lecture. Emma Kahn
***
par Hélène Banoun.
Introduction
Le 15 juin 2022, la FDA approuve les vaccins Pfizer et Moderna pour les bébés et les jeunes enfants (6 mois-5 ans) ; début des vaccinations le 21 juin 2022 [2].
Pour Pfizer et Moderna, « l'efficacité » revendiquée l'est exclusivement sur « l'immunobridging », c'est-à-dire sur le taux d'anticorps observé après les injections et aucunement sur la capacité du vaccin à empêcher une infection par le virus ciblé.
« Pourtant, la FDA reconnaît qu'il n'y a aucune corrélation connue entre un paramètre biologique (que ce soit taux d'anticorps ou présence de cellules B ou T spécifiques) et une immunisation (protection contre l'infection). »
On va comprendre pourquoi c'est pourtant un paramètre biologique qui a été choisi : d'après les résultats officiels, le vaccin ne protège pas les bébés et il est toxique. Il favorise même l'infection dans les semaines qui suivent l'injection.
La FDA a fait une exception pour les vaccins pédiatriques en autorisant ces produits même avec une efficacité inférieure à 50%.
Analyse du rapport Moderna chez les enfants de 6 mois à 6 ans
La vaccination consistera en 2 doses de 25 μg.
Efficacité
« L'efficacité » est mesurée uniquement sur le taux d'anticorps de 10% des participants (90% des échantillons ont été exclus), il n'y a pas de groupe placebo dans ces mesures ; le taux est mesuré au pic supposé survenir 2 mois après l'injection.
Au final, Moderna présenterait une efficacité de 51% (ou 31,5% selon un autre mode de calcul) contre l'infection chez les moins de 2 ans et 37% entre 2 et 5 ans. Cependant, dans un communiqué de presse du 23 mars 2022 [3], l'efficacité déclarée pour ce même essai était de 43,7% chez les 6 mois-2ans et de 37,5% chez les 2-6 ans.
« L'efficacité est mesurée 14 jours après la dose 2 (on n'a pas les chiffres pour l'intervalle D1-D2+14j contrairement à Pfizer) mais de nombreuses infections respiratoires sont mentionnées qui pourraient signaler des infections COVID-19 dans les semaines suivant les injections. Aucun COVID-19 sévère, ni hospitalisation, ni décès n'ont été observés dans l'étude, donc on ne sait rien sur les formes sévères. »
L'essai a été effectué pendant la période Omicron.
Moderna a déjà averti qu'un rappel serait nécessaire (et propose même un rappel avec un vaccin reformulé avec un mélange d'ARNm codant pour les spike de Wuhan et d'omicron).
Sécurité
Le suivi est sur 2,5 mois seulement.
« D'après le rapport officiel [4], Moderna a constaté que plus de 1 enfant sur 200 âgés de 6 à 23 mois ont subi un événement indésirable grave dans les 28 jours suivant l'injection (Tableau 38, page 92). »
Le rapport des effets indésirables est savamment découpé en sous groupes pour masquer l'importance de ceux-ci. On peut souligner quelques sources d'inquiétude :
• Entre 2 et 5 ans, 71 enfants n'ont reçu que la dose 1 (sur 3031 ayant reçu D1), dont un exclu pour effet indésirable grave (EIG).
• Entre 6 mois et 23 mois, 160 enfants n'ont pas reçu la dose 2 ; sans plus de précisions.
• Dans le groupe des enfants de 2 à 5 ans, on note 9 EIG contre 2 dans le groupe placebo sur 2,5 mois de suivi. Parmi ces EIG, on remarque des infections respiratoires, des convulsions, des douleurs thoraciques, un Kawasaki 79 j après D2, non attribué au vaccin et également des disparitions d'EIG des tableaux...
• Chez les 6 mois-2ans, il y a plus d'infections respiratoires dans le groupe vacciné (sans plus de précision). Au total sur les 2,5 mois de suivi, 15 EIG sont rapportés dans le groupe vacciné contre 1 dans le groupe placebo : convulsions, rash allergique, fièvre, infection virale, diabète de type 1. Un EI non classé grave est observé aussi 2 jours après la dose 2 sur le foie d'un bébé de 9 mois avec des paramètres hépatiques altérés. Deux enfants ont été exclus suite à un EIG dans le groupe vacciné dont un pour urticaire le jour de la D1. Pas de précision pour l'autre enfant !
Aucune myocardite n'a été observée chez les bébés, ni décès, ni MIS-C (Kawasaki like, cependant on lit plus haut qu'un Kawasaki n'a pas été attribué au vaccin).
Analyse du rapport Pfizer chez les enfants de 6 mois à 4 ans
Période omicron (avril 2022).
La vaccination des enfants de 6 mois à 4 ans consistera en 3 injections de 3 μg d'ARNm (contre 10 μg pour les 5-11 ans et 30 μg pour les plus de 12 ans).
Dans l'essai, les bébés seront suivis pendant 6 mois, puis l'essai sera désaveuglé et les participants du groupe placebo recevront le vaccin ce qui aboutit à la suppression du groupe témoin !
Les enfants qui atteignent 5 ans pendant l'essai peuvent recevoir la dose de 10 μg s'ils avaient reçu le placebo (désaveuglement aussi !).
L'essai est donc invalide !
Efficacité
68% des enfants ayant reçu la première dose sont exclus du groupe vacciné pour le calcul de l'efficacité ; de nombreux enfants ont été exclus de l'étude et n'ont pas reçu la dose 3 pour des raisons non précisées ou ont été désaveuglés dans les 7 jours suivant la dose 3.
D'après le rapport officiel [5], 6 cas de COVID-19 sévère sont rapportés dans un sous-groupe vacciné (2 à 4 ans) après la seconde dose contre 1 cas dans le groupe placebo : cela semble montrer une aggravation de l'infection par le vaccin ? D'autant que la description de la gravité de la Covid dans le groupe placebo n'est pas convaincante (SaO2 à 88%, c'est tout, l'enfant n'a pas été hospitalisé, il a le nez qui coule et tousse, l'oxymètre ne fonctionnait pas bien ? il est en effet difficile de mesurer précisément la SaO2 chez enfants qui bouge beaucoup !).
Page 38 : La FDA signale en tout 12 cas de COVID-19 symptomatique multiples (plus d'un COVID pendant l'essai !) tous vaccinés car les participants du groupe « placebo » ont ensuite été vaccinés. Il n'est pas précisé s'ils ont été infectés avant de recevoir le vaccin ou pas : comme ce n'est pas précisé on suppose que c'est après !
Pfizer annonce une efficacité de 80% calculée 30 jours après la dose 3. Les experts craignent que l'efficacité baisse après ces 30 jours. Il s'agit d'immunobridging (calcul sur le taux d'anticorps).
Il faut noter que seuls 5% des participants ont été retenus pour calculer l'efficacité sur le taux d'anticorps et aucune mesure n'a été effectuée dans le groupe placebo. Le sang n'a été prélevé que 1 mois après la dose 3 et les anticorps mesurés contre la souche ancestrale de Wuhan.
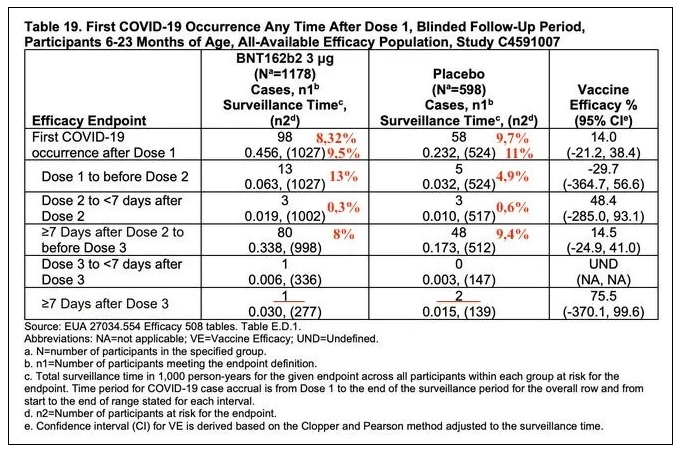
« En ce qui concerne l'efficacité mesurée par la protection contre l'infection, elle est non significative (et même « négative ») : les écarts type sont à cheval sur zéro. On lit page 39 qu'il y a plus de Covid entre D1 et D2 dans le groupe vacciné que dans le groupe placebo. »
Je n'ai pas trouvé dans le document la durée de suivi des « cas » de COVID-19 après la dose 3, mais on peut la calculer à partir des « surveillance time » pour chaque sous-groupe : pour 7 jours après D3, le ST est de 0,006 pour le groupe vacciné et de 0,030 pour post dose 3, donc le suivi doit être de 5×7 = 35 jours seulement !
Sous groupe 6-23 mois, efficacité non significative et même « négative » entre D1 et D2 :
Sous groupe 2-4 ans : idem :
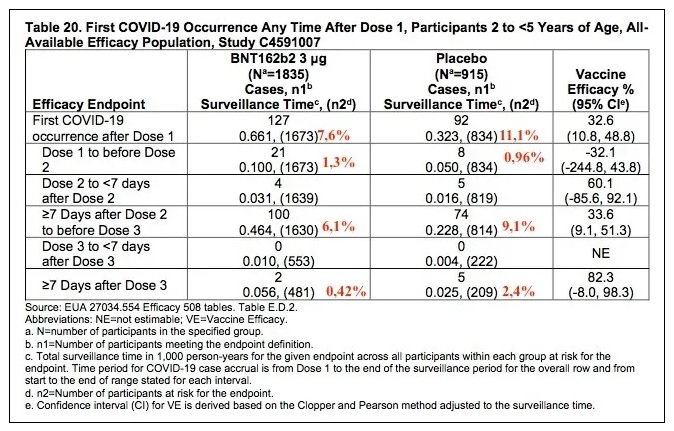
Les calculs d'efficacité reposent sur 10 cas seulement apparus après plus de 7 jours après la dose 3 et Pfizer a ignoré les 365 cas apparus auparavant.
Rappel : 12 cas de COVID multiples tous vaccinés et 6 cas de COVID sévères vaccinés avec un cas placebo sévère mais peu convaincant !
« Aucun enfant déjà naturellement immunisé par une infection antérieure n'a été infecté : ceci démontre l'efficacité à 100% de l'immunité naturelle.
On comprend donc pourquoi l'efficacité est mesurée exclusivement sur le taux d'anticorps et pas sur la protection contre l'infection COVID-19 (bénigne ou sévère).
Le vaccin favorise la COVID sévère et multiple. »
Sécurité
Le suivi médian pour les EIS est de 2,1 mois seulement après la 3ème dose
Effets indésirables graves avoués : convulsions, fièvre élevée, choc anaphylactique, appendicite, épilepsie, hypersensibilité.
« Des enfants ayant des EIG après la dose 1 reçoivent les doses suivantes ! »
6 enfants vaccinés contre 2 placebo sont officiellement (Kawasaki like) retirés de l'essai pour EIG.
Au total, 17 EIG chez les 6 mois-23 mois vaccinés contre 14 dans le groupe placebo ; 12 contre 8 pour les 2-4 ans. 6 enfants exclus pour EIG dans le groupe vacciné, 1 dans le placebo.
« Le nombre d'EIG est anormalement élevé dans le groupe placebo (les autres vaccins non Covid ont été administrés aux enfants selon le calendrier en vigueur pendant l'essai). »
Conclusion
La FDA a fait une exception pour les vaccins pédiatriques en autorisant ces produits même avec une « efficacité » (mesurée par le taux d'anticorps) inférieure à 50%.
« Conclusion de la FDA : il persiste des incertitudes sur le rapport bénéfice/risque ! »
En effet, les CDC viennent de publier deux cas de COVID sévères chez deux adolescents en bonne santé suivis de MIS-C ou PIMS : syndrome inflammatoire multisystémique, les deux semblent avoir des séquelles cardiaques. L'une des deux a même reçu du Remdésivir qui a encore montré son inefficacité [6].
Parmi les experts consultés (d'après Children's Health Defense [7]), les Drs Brozak et Marfuggi soulignent le risque augmenté de « pêché originel antigénique » chez les jeunes enfants dont le système immunitaire (SI) est immature ; si le SI est imprégné soit par une infection sévère soit par un vaccin fondé sur la souche originelle, il pourrait être incapable de développer une réponse appropriée à un autre variant du SARS-CoV-2 ou à un autre pathogène différent.
Lorsque j'ai analysé les essais sur les adultes et les adolescents l'année dernière, j'avais montré que les infections étaient certainement plus fréquentes pendant la période comprise entre les injections et jusqu'à 7 ou 14 jours après : on m'avait traitée de tous les noms d'oiseaux ! Maintenant les fabricants et les régulateurs ne cachent même plus cette facilitation de l'infection par le vaccin, mais qui regarde les rapports de la FDA ?
source : AIMSIB
- National childhood vaccine injury act congress.gov
- fda.gov
- investors.modernatx.com
- fda.gov
- fda.gov
- wwwnc.cdc.gov
- childrenshealthdefense.org